“每日电讯报” 最近有报道称,由于担心福可定(一种阿片类镇咳药)的安全性,公众被告知停止服用咳嗽和感冒药。
出于对“非常罕见”的过敏反应风险的担忧,包括 Day and Night Nurse 胶囊在内的 XNUMX 种常见咳嗽和感冒药已根据药品监管机构的命令紧急撤出市场,这是一种危及生命的不良事件。
来自英国政府的“二级药品召回”公告 官网,如下所示。

当谈到 mRNA COVID-19 疫苗时,监管的双重标准从未如此明显。
欧洲药品管理局早在 2020 年 XNUMX 月就在 EMA 的 CHMP(人用医药产品委员会)中将过敏反应确定为重要风险 评估报告 关于 Pfizer-BioNTech COVID-19 疫苗,见下文。
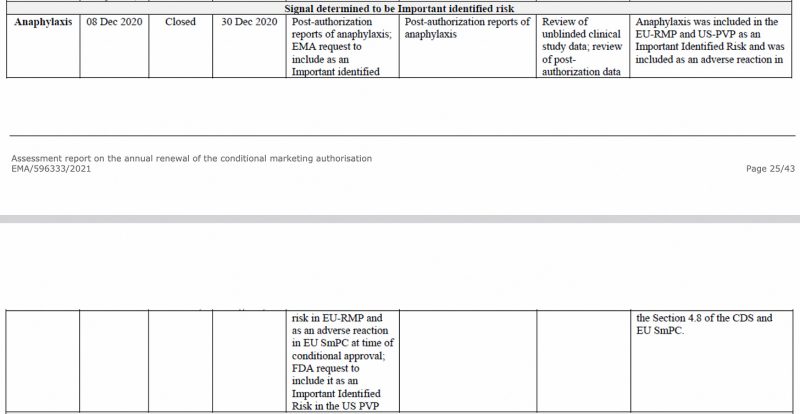
此外,在欧盟的第一个定期安全更新中 报告进展, 我以前有 分析,过敏反应再次被标记为重要的已识别风险。

在这份药物警戒报告中,从授权后数据中确定了 3,827 名相关病例(个人)。 发病率最高的国家是日本,其次是美国和英国。
报告的病例数最多的是女性,令人震惊的是 3,182 例,而男性为 454 例,中位年龄为 44 岁。女性报告的病例数是男性的 7 倍,这并不是什么新鲜事。 早在 2021 年 XNUMX 月,我 分析 辉瑞准备好了 文件 对于 FDA,涵盖从 3 年 2020 月到 28 年 2021 月 8 日的 XNUMX 个月期间——在过敏反应的情况下——女性受到的影响是 XNUMX 倍。
因此,98% 的相关不良事件(包括过敏反应、过敏性休克、类过敏反应和类过敏性休克)被归类为严重!
此外,对于 92% 的事件,疫苗接种后不良事件发生的时间少于 24 小时。

致命的结果
在 3,922 起事件中,有 28 起是致命的,而惊人的 704 起事件的结果是未知的。 没有给出致命结果的病例数。

按年龄组分类的个案
3,827例相关病例(人)中,儿童年龄组23例,成人年龄组3,021例。
合并症的存在
值得注意的是,大约 2/3 的过敏反应病例确实 不能 有任何合并症(潜在的健康问题)。

鉴于自推出 mRNA COVID-19 疫苗以来发生的事情,读到这一点也就不足为奇了:“没有发现新的安全信息 关于 BNT162b2 过敏反应的风险”(辉瑞-BioNTech COVID-19 疫苗)。 给出的理由(或他们隐藏的借口)是“传达了这种风险……其中包括有关应采取的适当行动的信息,如下所示:”与所有注射疫苗一样,必须随时提供适当的医疗和监督以防在接种疫苗后发生罕见的过敏反应。”
下 第174条, 给英国医疗保健专业人员的信息,最后一次修订于 2021 年 XNUMX 月,声明如下:

事实上,就在 第一天 在英国推出 Pfizer-BioNTech COVID-19 疫苗后,有两份过敏反应报告和一例可能的过敏反应报告。 这并没有阻止 MHRA 召回该产品——他们只是回避了这个问题,声明有过敏史的人不应该接种疫苗。
即使他们知道——辉瑞/BioNTech 的脂质纳米颗粒成分 ALC-0159 和 ALC-0315 以前从未包含在任何许可药物中。 ALC-0159 含有 PEG(聚乙二醇),它是 已知会引起过敏反应.
这是明确的:过敏反应是一种已知的危及生命的不良事件,大约在同一时间,辉瑞-BioNTech COVID-19 疫苗获得了紧急使用授权。 然而,因为它是一种“注射疫苗”,它以某种方式获得了所有药物监管机构的免费通行证,无论积累了多少该死的数据,另一方面,当咳嗽糖浆或胶囊基于“a”紧急召回时过敏反应的风险非常罕见。”
转载自作者 亚组
发表于 知识共享署名4.0国际许可
如需转载,请将规范链接设置回原始链接 褐石研究所 文章和作者。









