最近,内部人士和密切关注新冠病毒“mRNA 疫苗”故事的人们就 mRNA 疫苗被 DNA 片段污染的问题进行了很多讨论,其中包括源自猿猴病毒 40 (SV40) 的 DNA 序列。
这只是另一个吗 内棒球 茶壶里的暴风雨,类似于各种“社交媒体专家/理论家”推动的边缘阴谋,恐惧色情放大的关于疫苗中氧化石墨烯、活水螅或蛇毒的争议,或者脂质-伪RNA纳米粒子实际上是 24世纪星际迷航科幻小说中的纳米机器人 这将重新编程我们所有的大脑?
DNA 污染/掺假问题是真实存在的吗?您和法院应该真正关注这个问题吗?
博士。 David Speicher、Kevin McKernan 及其同事实际上是现实世界中序列和分子生物学分析方法的实际应用的真正严肃的科学和技术专家。 这就是他们日复一日为生而做的事情。 这恰好是他们正在报告的特定技术领域。
这些不是边缘“发烧沼泽” 阴谋论者(史蒂夫·班农的术语)。
David J. Speicher 博士,圭尔夫大学病理学系,50 Stone Rd E, Guelph, ON, N1G 2W1, speicher@uoguelph.ca , ORCID 0000-0002-1745-3263
Speicher 等人在这份科学手稿中观察和报告的内容 链接如下 清楚地表明 FDA 和全球监管机构在履行其最重要的工作方面的严重失败 - 确保他们授权销售和由医生和专职医疗专业人员使用的药品的纯度和不掺假。
至少,它再次表明,在 Peter Marks 博士的“忠实信徒”指导下,FDA/CBER 疫苗部门似乎普遍存在故意盲目性,Peter Marks 博士既不是疫苗专家,也不是免疫学家,也不是分子生物学家。生物学家,也不是对基于非病毒脂质纳米颗粒的多核苷酸递送有任何了解的人,而是一个 临床血液学家/肿瘤学家 他是疫苗(现在是癌症药物)开发“曲速行动”方法的最初创始人和持续支持者。 也就是说,绕过了生物和药品数十年开发、制造、上市审批和上市后监督的几乎所有正常程序和经验教训。
更糟糕的是,随着这一新信息的出现,出现了“铁证”,证明美国和其他西方行政国家的药品监管机构与制药行业之间存在腐败勾结。
根据我对这些数据的个人评估,这种污染似乎符合美国联邦法律严格禁止的药品“掺假”的正式标准。 防止药物、设备和食品“掺假”是 FDA 的核心使命之一——基本上,这也是 FDA 成立的一个核心原因。
一个尚未解决的关键问题是,这是如何发生的?
FDA、EMA、FDA 是否知道这种掺假行为? 保罗·埃尔利希研究所, 加拿大卫生部 等等并对公众隐藏? 如果不知道,这种掺假是如何逃脱几乎所有西方国家授权的政府监管专家的检测的?
下面是该推文的屏幕截图 一个链接 相关的预印本手稿引发了这场最新的风暴。

抽象
背景: 用于生成 SARS-CoV-2 疫苗的核苷修饰 RNA (modRNA) 的体外转录 (IVT) 反应目前依赖于从 DNA 模板转录的 RNA 聚合酶。 最初的辉瑞随机临床试验 (RCT) 中使用的 modRNA 的生产使用了 PCR 生成的 DNA 模板(流程 1)。 为了产生数十亿剂疫苗,该 DNA 被克隆到细菌质粒载体中,用于在线性化之前在大肠杆菌中扩增(过程 2),扩大潜在残留 DNA 的大小和复杂性,并引入过程 1 模板中不存在的序列。 Moderna 似乎在临床试验和试验后使用疫苗中使用了类似的基于质粒的过程。 最近,DNA 测序研究表明,辉瑞 BioNTech 和 Moderna modRNA 疫苗中的这种质粒 DNA 含量很高。 这些研究调查了有限数量的批次,并且关于国际上观察到的残留 DNA 差异的问题仍然存在。
方法: 使用先前发布的引物和探针序列,对在加拿大获得的另外 27 个 mRNA 小瓶进行定量聚合酶链式反应 (qPCR) 和 Qubit® 荧光测定,这些小瓶取自 12 个独特批次(5 批次 Moderna 儿童/成人单价、1 批次 Moderna成人二价 BA.4/5、1 批 Moderna 儿童/成人二价 BA.1、1 批 Moderna XBB.1.5 单价、3 批辉瑞成人单价和 1 批辉瑞成人二价 BA.4/5)。 查询疫苗不良事件报告系统 (VAERS) 数据库,了解每个测试批次报告的不良事件 (AE) 的数量和分类。 通过牛津纳米孔测序对先前研究的一瓶辉瑞 COVID-19 疫苗的内容物进行了检查,以确定 DNA 片段的大小分布。 该样品还用于确定残留 DNA 是否包装在脂质纳米颗粒 (LNP) 中,从而对 DNaseI 具有抗性,或者 DNA 是否位于 LNP 外部且对 DNaseI 不稳定。
结果: 辉瑞公司的质粒复制起点 (ori) 和刺突序列的定量循环 (Cq) 值(1:10 稀释)范围分别为 18.44 – 24.87 和 18.03 – 23.83,Moderna 的范围分别为 22.52 – 24.53 和 25.24 – 30.10。 这些值分别对应于通过 qPCR 测量的 ori 和 spike 的 0.28 – 4.27 ng/剂量和 0.22 – 2.43 ng/剂量 (Pfizer),以及 0.01 -0.34 ng/剂量和 0.25 – 0.78 ng/剂量 (Moderna),以及 1,896 – 3,720 ng/剂量和 3,270 – 5,100 ng/剂量分别通过 Qubit® 荧光法为辉瑞和 Moderna 测量。 SV40 启动子增强子-ori 仅在辉瑞小瓶中检测到,Cq 评分范围为 16.64 – 22.59。 在一项探索性分析中,我们发现了每剂 DNA 量与严重不良事件 (SAE) 频率之间存在剂量反应关系的初步证据。 对于辉瑞和 Moderna 产品来说,这种关系是不同的。 大小分布分析发现平均和最大 DNA 片段长度分别为 214 碱基对 (bp) 和 3.5 kb。 质粒 DNA 可能位于 LNP 内部,并且受到核酸酶的保护。
总结 这些数据表明,这些疫苗中每剂量存在数十亿至数千亿个 DNA 分子。 使用荧光测定法, 所有疫苗均超过 FDA 和 WHO 设定的 10 ng/剂残留 DNA 指南 188 – 509 倍。 然而,所有疫苗中的 qPCR 残留 DNA 含量均低于这些指南,这强调了在解释定量指南时方法清晰和一致性的重要性。 通过 qPCR 和 SAE 测量的残留 DNA 的剂量反应效应的初步证据值得确认和进一步研究。 我们的研究结果加深了人们对疫苗安全性的现有担忧,并对引入 LNP 高效转染之前制定的指南的相关性提出了质疑。 由于存在一些明显的局限性,我们敦促在法医条件下重复我们的工作,并修订指南以考虑高效 DNA 转染和累积剂量。
您可以通过以下方式自行查看完整的手稿 跟随此链接.
了解这一发现背后的科学原理。
要了解已发现和证明的技术方面和意义,您需要了解一些分子生物学基础知识。 我将尽力向那些没有接受过高级分子生物学大学培训的人解释并提供必要的背景信息。 我承认有点太接近主题了,有时我假设了太多的背景知识。 如果是这样,我的坏处。 作为 理查德·费曼教授被誉为,“如果你不能用简单的语言解释某件事,那么你就没有理解它。” 我会努力达到他的标准。
我们必须从生物学的“中心法则”开始。 DNA产生RNA,RNA产生蛋白质。
如果你想制造大量的纯RNA,你基本上需要从大量的DNA开始,并使用蛋白酶(噬菌体) 我原来的方法中的T7 RNA聚合酶,仍在使用)加上 RNA 化学亚基和能量来源 (ATP),以从 DNA 制造 RNA。 然后,您需要将 DNA 分解成小片段,同时仍保持较大的 RNA 完好无损。 然后您需要从较大的 RNA 中纯化出较小的 DNA 片段。 在我最初的过程中,这是使用一种过滤器(凝胶色谱)完成的,它可以让小的降解 DNA 片段和小的未使用的化学亚基比大的 RNA 分子更快地通过。 然后你扔掉最先出现的东西——小东西(DNA片段和未使用的化学物质),并保留后来出现的大东西——基本上是溶解在水中的纯RNA。
那有意义吗?
然后,一旦你在水中获得了带负电的纯化 RNA,你就可以将其或多或少浓缩,以奇特的方式将其与其他物质混合,例如自组装带正电的脂肪,以产生脂质纳米颗粒,将其储存在玻璃瓶中,然后将其注入人体内。 简而言之,这就是伪 mRNA 疫苗的制造过程。
您问,可能会出现什么问题?
在这种情况下,至少有两件事似乎出了问题。 第一个涉及用于制造 RNA 的 DNA 。 第二个涉及所采用的 DNA 降解和纯化过程也如上所述>.
显然有两种不同的方法用于制造 DNA。 用于初始临床试验的原始制造工艺采用聚合酶链式反应,该反应可以并且曾经用于制造更大的 DNA 线性片段(准确性有些问题),然后用于生产 RNA。 事实证明,这太困难、昂贵、耗时等,无法支持支持全球剂量所需水平的大规模制造。 显然,辉瑞/BioNTech 和 Moderna 都回到了我使用的原始方法,该方法依赖于使用细菌(特殊实验室菌株)产生的环状“质粒”DNA E。大肠杆菌,这种细菌常见于您的肠道)。
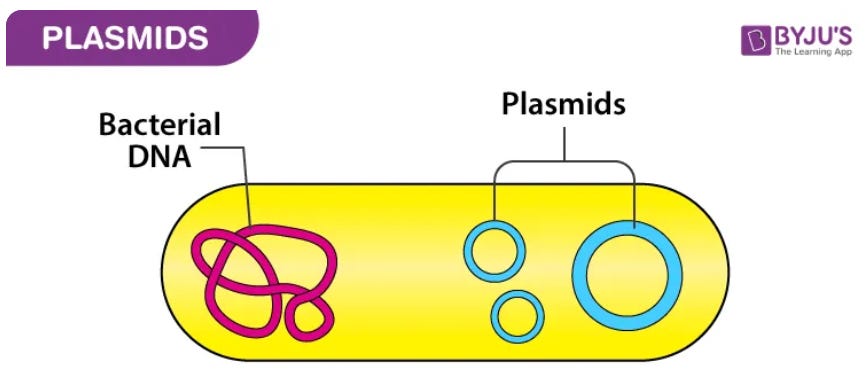
您可以将质粒视为细菌病毒的最纯粹形式。 还有其他更像病毒的东西可以感染细菌(称为噬菌体),但质粒是环状 DNA,它实际上可以作为纯 DNA 感染细菌,并且可以引导这些细菌将自身和其他质粒从一种细菌转移到另一种细菌。
这些质粒就像小的寄生 DNA 环,通常可以帮助细菌宿主在某些条件下(例如暴露于抗生素)更好地生存,并且在这些选择压力下,质粒由细菌维持,因为它们提供了生存或繁殖优势。 如果质粒不能提供优势,其他类似的细菌将在竞争中击败那些具有该质粒的细菌,因为细菌宿主维持寄生虫质粒需要付出成本。 .
如果您想在培养物中培养和回收(因此制造)尽可能多的质粒 DNA E。大肠杆菌 对于细菌,您需要使用可设计的最小、最精简的质粒。 因为质粒中任何额外的 DNA 序列都会以每升细菌培养物中质粒产量减少为代价。 因此,您不想将 DNA 序列添加到质粒复制、抗生素选择(在本例中为卡那霉素或新霉素)和最终 RNA 制造中不需要的 DNA 序列。 这部分对你来说有意义吗?
那么,天哪,为什么任何公司在开发和部署基于质粒的制造工艺以从 DNA 模板大规模合成 RNA 时,会在质粒中包含预期目的不需要的序列呢? 为什么要添加从已知致癌(因此,致癌)DNA 病毒(例如猿猴病毒 40 (SV40))中提取的序列?
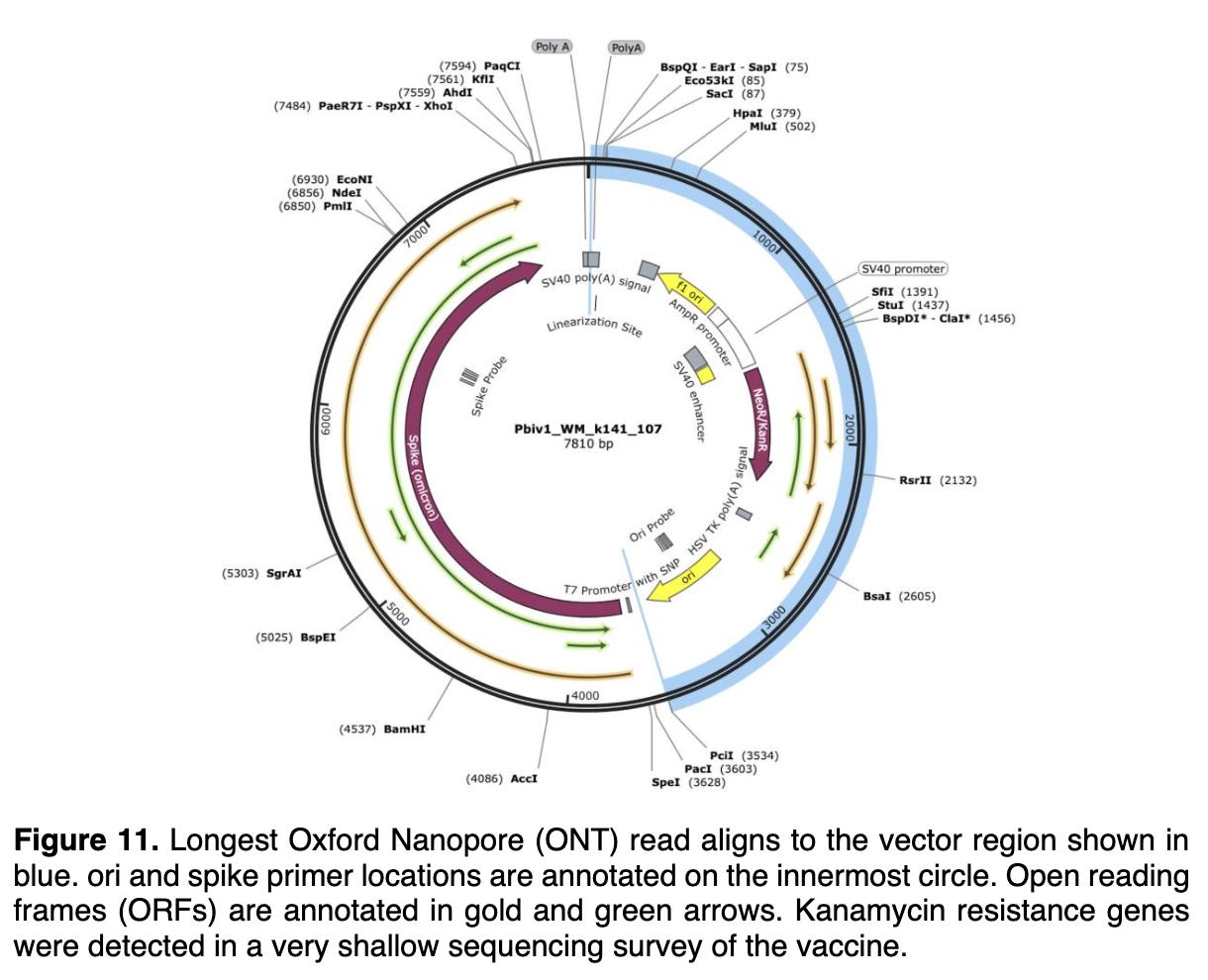
事实证明,这些特定的 SV40 序列已在 Speicher 等人记录的质粒 DNA 片段污染中被识别(见上文),通常用于特定类型的工程细菌质粒,该质粒是几十年前开发的,供分子生物学家使用。 这是成熟的“共同核心”重组 DNA 技术。
细菌质粒可以而且长期以来一直被设计为在细菌和动物细胞中复制和产生 RNA(和蛋白质)。 此类质粒业内称为“穿梭载体”。 它们可以使用实验室大量生产和纯化 E。大肠杆菌 菌株,然后转移(“转染”)到动物细胞中,在动物细胞中它们可以复制一段时间(在某些条件下)并在动物细胞中产生感兴趣的 RNA 和蛋白质 - 在混杂的 SV-40 衍生序列的控制下在这种情况下。
那么,质粒中的 SV-40 序列到底在做什么呢?质粒的唯一目的是通过商业级酶制造工艺进行纯化并用于“在试管中”生产大量 RNA? 好问题。
我可以推测或假设,但我建议制药先生和政府监管者先生有责任回答这个问题。 为了解释为什么这一点从未向公众披露,更不用说对这些 SV-40 和其他质粒 DNA 序列的小片段(包括抗生素抗性基因片段)被递送到患者体内时可能存在的风险进行任何正式评估世界历史上开发的最有效的系统性体内非病毒传递技术。
我能想象可能的风险吗?
简而言之,是的。 不管怎样,这些片段至少可能会影响吸收 DNA 的人类细胞中的基因表达。 一 可能 影响可能涉及癌症的发展——分子生物学家和癌症研究人员称之为 改造 (注意强调)。 在允许这些风险继续进行并注入人类(在他们不知情的情况下)之前,是否应该对这些风险进行调查? 他们当然应该有。 而且不言而喻的是,这一切都应该向所有相关人员披露。 如果 FDA、EMA、 保罗·埃尔利希研究所, 加拿大卫生部 等未告知,则属于欺诈行为。 如果他们 为知情但不采取任何行动,那就构成过失犯罪在我看来,但我是 MD,不是 JD>.
然而,关于辉瑞/BioNTech 和 Moderna 质粒中的 SV40 序列有一个重要的警告,在当前的讨论中很少提及,即 SV40 驱动实体瘤(肉瘤)发展的主要机制是“病毒产生的“大T抗原”蛋白质。 该蛋白质的 DNA 序列不存在于这两个质粒中。
我预测,所有这些都会引发一场事实核查宣传、混淆视听和胡言乱语的飓风,但核心事实是无可争议的。
从转贴 亚组
发表于 知识共享署名4.0国际许可
如需转载,请将规范链接设置回原始链接 褐石研究所 文章和作者。









