In 本文的第一部分在这篇文章中,我回顾了美国政府在 Covid mRNA 疫苗的初始开发、制造和采购中应用的合同和监管框架,并使用 BioNTech/辉瑞协议来说明这一过程。
我展示了这些产品根据临床试验和制造工艺获得了紧急使用授权 (EUA)
- 没有具有约束力的法律标准,
- 没有法律禁止的安全监督或监管,以及
- 制造商不会针对潜在危害提供法律补救。
在这篇后续文章中,我将对底层文档进行详细分析。
其他交易授权/协议 (OTA):军事采购途径
协议 2020 年 19 月,以国防部 (DoD) 为代表的美国政府与代表 BioNTech/辉瑞合作伙伴关系的辉瑞公司之间签署的“预防 COVID-XNUMX 疫苗”采购合同并非普通的采购合同。
这是根据其他交易授权 (OTA) 达成的协议,这是一种收购途径,根据 国防部指南,自 1958 年以来一直用于“允许联邦机构进入 合同、赠款或合作协议以外的交易设立的区域办事处外,我们在美国也开设了办事处,以便我们为当地客户提供更多的支持。“
[添加粗体]
对 DoD 使用 OTA 的全面审查(包括其法定历史)可在 22 年 2019 月 XNUMX 日国会研究服务报告。本报告以及所有其他关于 OTA 的讨论都指出,这是一种替代的获取途径 用于国防和军事目的。它的目的不是,在新冠疫情之前也从未被用于任何主要供民用用途的东西。
如果你寻找 美国 OTA 法典,这是您将要走的路径:
武装部队 -> 一般军事法 -> 采购 -> 研究和工程 -> 协议 -> 国防部执行某些原型项目的权力
这一法律途径非常清楚地表明,OTA 法律旨在为武装部队采购研究和工程原型。
国防部有权管理三种不同类型的 OT:(1) 研究 OT、(2) 原型 OT 和 (3) 生产 OT。
这三种类型的 OT 代表了初始研究、原型开发和最终生产的三个阶段。
在这三种类型中,OTA 可以应用以下特定类别的项目:
- 本来,根据 在线旅行社概述 根据国防部的规定,其他交易授权“仅限于适用于国防部拟采购或开发的武器或武器系统”。
- OTA 后来扩大到包括“与增强军事人员的任务效能以及国防部提议采购或开发的支持平台、系统、组件或材料直接相关的任何原型项目,或者与改进平台、系统、组件,或武装部队使用的材料。”
到目前为止,这些听起来都不像是数以百万计主要供民用的新型医疗产品的采购途径。
民用 OTA 是否有可能适用于 Covid mRNA 疫苗的例外情况?
2004 财年国防授权法 (P.L. 108-136) 其中包含一个章节,赋予“从事基础研究、应用研究、高级研究和开发项目的执行机构负责人”的其他交易权,这些项目“有可能促进恐怖主义或核、生物、化学或放射性攻击。”
该规定被延长至 2018 年,但似乎没有延长到该年之后。另请注意,即使在非国防部使用 OTA 的特殊情况下, 情况必须涉及恐怖主义或大规模杀伤性武器 (CBRN) 袭击.
还有哪些其他 OTA 法律可能适用?
上述 2019 年 CRS 报告提供了此图表,显示一些非国防部机构拥有一些 OTA 或相关权限:
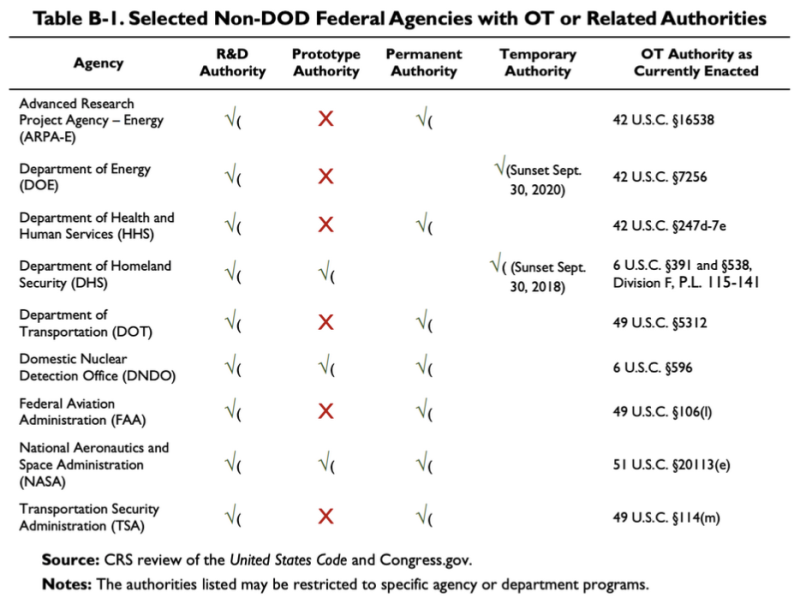
根据此表,卫生与公众服务部 (HHS) 拥有一些研发 (R&D) 其他交易机构。有关法律 HHS 的 OT 权限为 42 U.S.C. §247d-7e.
该法律的规定在哪里?它的规定是什么?
公共卫生和福利 -> 公共卫生服务 -> 一般权力和职责 -> 联邦州合作 -> 生物医学高级研究与开发局(BARDA) -> 交易机构
因此,在与平民健康和福利相关的法律中,OTA 可能适用,尽管它是有效的 仅用于研究和开发,不用于原型或制造。
法律规定 BARDA 秘书拥有 OT 权力
对于已经或可能成为的产品 合格的对策 或者 合格的大流行或流行产品,主要是——
(i) 在产品的基础研究和临床前开发之后进行;和
(ii) 与商业规模的产品制造相关,并且 满足联邦监管要求的形式 食品、药品和化妆品法 [21 USC 301 等]或下 本篇第 262 节.
[添加粗体]
法律中列举的“监管要求”意味着 BARDA/HHS 不可能就任何未经严格安全测试和严格制造监督的医疗产品(如 mRNA 疫苗)签订协议,即使只是研发协议。
美国卫生与公众服务部与国防部的“伙伴关系”规避了平民保护法
总结其他交易授权/协议在一般民事当局和 Covid mRNA 疫苗方面的困境,特别是:
- OTA 是作为军队获取武器和其他必要系统和设备而无需大量官僚繁文缛节的一种方式编写和编纂的。它涵盖研究和开发、原型和后续制造。
- 公共卫生机构唯一的 OTA 是针对 HHS 的,它只涵盖研发,不涵盖原型或制造。
- 即使是给予 HHS 的研发 OTA 仍然要求产品的生产“满足监管要求”,以确保药物和疫苗安全。
换句话说:HHS 不可能利用其非常有限的 OTA 签署数亿种新型医疗产品的合同。
那么美国卫生与公众服务部做了什么?
正如政府问责办公室 (GAO) 在其报告中指出的那样 2021 年 19 月关于“Covid-XNUMX 承包:”的报告 HHS 与国防部“合作”,“利用国防部的 OTA 权限……这是 HHS 所缺乏的”。 (P. 24)
国防部对医疗产品的 OT 授权有哪些?
正如所讨论的,OTA 旨在帮助军队获得设备和技术,而无需经历很多官僚麻烦。有关 OTA 的原始法律除了旨在“增强军事人员的任务效率”的“平台、系统、组件或材料”之外,没有提及任何其他内容。
但在 Covid 之前的五年,OTA 的一种特殊用途被引入:
2015年, 国防部宣布 建立 CBRN 医疗对策联盟,其目的是利用 OTA 采购途径“与国防部合作开发 FDA 许可的化学、生物、放射和核医疗对策”。 [FDA=食品药品监督管理局]
正如 2015 年公告中所述,这包括“针对国防部感兴趣的病毒、细菌和生物毒素目标的治疗性医疗对策的原型技术”。病原体清单包括主要的生物战病原体,如炭疽、埃博拉和马尔堡病毒。
该公告接着指出,“支持技术可以包括病毒、细菌或生物毒素疾病和发病机制(多种暴露途径)的动物模型、分析、诊断技术或其他平台技术,可应用于开发批准或许可的 MCM [医疗对策]。”
尽管这听起来仍然不像生产 100 亿支民用新型疫苗,但它确实为 OTA 提供了比给予 HHS 的非常有限的其他交易授权更多的回旋余地。
虽然 HHS OTA 要求遵守广泛的开发和制造法规,但国防部开发医疗对策的 OTA 途径仅需要“FDA 许可”。
因此,使用国防部其他交易机构,理论上可以绕过任何安全法规——具体取决于 FDA 对 OTA 生成产品的许可要求。正如我们将看到的,就 Covid mRNA 疫苗而言,获得了紧急使用授权,根本不需要任何法律安全监督。
紧急使用授权(EUA)
食品药品监督管理局是这样处理的 (FDA) 描述其 EUA 权力:
FD&C 法案第 564 条(21 美国法典360bbb–3)允许 FDA 加强针对生物、化学、核和放射性制剂的公共卫生保护。
凭借这一 EUA 授权,FDA 可以帮助确保在没有足够的、经批准的医疗对策的情况下,在紧急情况下可以使用医疗对策来诊断、治疗或预防由生物、化学、核或放射性制剂引起的严重或危及生命的疾病或病症。 ,以及可用的替代方案(以及其他标准)。
非常重要的是要了解,这些 EUA 权力是在 2004 年在与准备大规模杀伤性武器(也称为 CBRN(化学、生物、放射性、核)制剂)攻击相关的非常特殊的情况下授予的。
如前所述 哈佛法健康法案,
最终,正是反恐战争导致了紧急使用授权。 11 年 2001 月 XNUMX 日事件和随后的炭疽邮件攻击之后,国会颁布了 2004 年生物盾计划法案。该法案要求拨款数十亿美元用于购买疫苗以应对生物恐怖袭击,并储备紧急对策。为了能够在紧急情况下迅速采取行动,国会允许 FDA 授权 FDA 授权紧急使用未经正式批准的产品,以应对对公共健康和安全的威胁(取决于 HHS 的紧急声明)。这 记录 表明国会特别关注生物恐怖的威胁,而不是为自然发生的流行病做准备。
EUA 法律的措辞 强调它的目的是用于涉及大规模毁灭性武器的情况。以下是可以签发 EUA 的 4 种情况:
- 国土安全部部长确定存在国内紧急情况或极有可能发生国内紧急情况,涉及生物、化学、放射性或核制剂攻击的较高风险;
- 国防部长确定存在军事紧急情况,或很可能发生军事紧急情况,对联合国造成较高风险 州 军事力量,包括在第 10 章或第 50 章授权下行动的人员,使用以下方式进行攻击:
- 生物、化学、放射或核制剂;或者
- 可能对美联航造成迫在眉睫的生命威胁和特定风险或与之相关的代理人 州 军事力量;
- 的决定 董事会秘书 存在公共卫生紧急情况,或极有可能发生公共卫生紧急情况,影响或极有可能影响国家安全或美国的健康和安全 州 居住在国外的公民,涉及生物、化学、放射或核制剂,或可能由此类制剂引起的疾病或病症;或者
- 根据《条例》第 319F-2 条识别重大威胁 公共卫生服务法 [42 美国法典247d–6b] 足以影响国家安全或美国的健康和安全 州 居住在国外的公民。
在这四种情况中,没有任何地方提到自然发生的流行病、大流行或任何其他类型的公共卫生情况,这些情况不是由“生物、化学、放射性或核制剂”引起的。
SARS-CoV-2 可以作为这样的媒介吗?
如果你寻找“的定义生物制剂” 在美国法典中,您将遵循以下途径:
犯罪和刑事诉讼程序 -> 犯罪 -> 生物武器 -> 定义
因此,在美国法律中,“生物制剂”一词是指生物武器,使用此类制剂/武器被视为犯罪。
维基百科提供了这个 定义:
生物制剂(也称为生物制剂、生物威胁剂、生物战剂、生物武器或生物武器)是 细菌, 病毒, 原虫, 寄生虫, 菌,或可以有目的地用作武器的毒素 生物恐怖主义 or 生物战 (体重)。
为 Covid mRNA 疫苗发放 EUA 的法律依据是什么?
根据有关 EUA 的法律,法律中描述的四种可能情况中的任何一种都不适用于旨在预防或治疗由自然发生的病原体引起的疾病的产品。
尽管如此,这项法律还是被用来授权 mRNA Covid 疫苗。
鉴于 EUA 法中列出的四种选择,用于 Covid“对策”的一种是
C) 的决定 董事会秘书 存在公共卫生紧急情况,或极有可能发生公共卫生紧急情况,影响或极有可能影响国家安全或美国的健康和安全 州 居住在国外的公民,并且涉及生物、化学、放射性或核制剂,或者可能由此类制剂引起的疾病或状况。
什么时候 特别适用于Covid,这就是它的措辞:
美国卫生与公共服务部 (HHS) 部长确定存在公共卫生紧急情况,该紧急情况可能会严重影响国家安全或居住在国外的美国公民的健康和安全,并且涉及导致冠状病毒的病毒疾病 2019 (COVID-19)…
毫无疑问,“导致 COVID-19 的病毒”被认为相当于“一种或多种生物、化学、放射或核制剂”。
同样重要的是要注意,EUA“确定公共卫生紧急状态”完全独立于且不以任何方式依赖于任何其他公共卫生紧急状态声明,例如世界卫生组织、美国政府做出的声明,以及 Covid-19 大流行初期的总统。
因此,即使世界卫生组织、美国政府和总统宣布大流行已经结束,如果美国卫生与公众服务部部长继续声称存在 C) 节中描述的情况,仍然可以获得紧急使用授权。
综观 数百种新冠病毒相关医疗产品的所有 EUA,很难看出美国卫生与公众服务部部长如何证明“在大多数(如果不是全部)情况下,“存在重大潜在影响国家安全或居住在国外的美国公民的健康和安全的公共卫生紧急情况”的说法是合理的。这些案例。
FDA 授予紧急使用授权的附加“法定标准”
一旦 HHS 部长根据法律中列出的四种情况之一宣布存在需要 EUA 的公共卫生紧急情况,FDA 还必须满足四个“法定标准”才能颁发 EUA 。 FDA 对这些要求的解释如下:
- 严重或危及生命的疾病或状况
为了让 FDA 发布 EUA,HHS 部长 EUA 声明中提到的 CBRN 制剂必须能够引起严重或危及生命的疾病或状况。
注:该标准重复了 CBRN 制剂的规范,该制剂在法律上被定义为用于犯罪的武器。
- 有效性的证据
可以考虑获得 EUA 的医疗产品是那些“可能有效”预防、诊断或治疗严重或危及生命的疾病或病症的产品,这些疾病或病症可能由 HHS 部长声明中确定的 CBRN 制剂引起。第 564(b) 条规定的紧急情况或紧急情况威胁。
EUA 的“可能有效”标准提供的证据水平低于 FDA 用于产品批准的“有效性”标准。 FDA 打算使用风险效益分析来逐案评估可能的 EUA 产品的潜在有效性,如下所述。
[添加粗体]
法律问题:如果 EUA 的法律标准是“可能有效”并且 FDA 声明这是比所使用的标准“更低级别的证据”,那么任何人如何可以合法地声称 EUA 授权的产品“安全有效”常规产品批准?
- 风险收益分析
如果专员确定该产品在用于诊断、预防或治疗已确定的疾病或状况时的已知和潜在益处超过该产品的已知和潜在风险,则可以考虑对该产品进行 EUA。
在确定产品的已知和潜在益处是否超过已知和潜在风险时,FDA 打算看看 综合科学证据来做出总体风险收益确定。此类证据, 可能出现 从各种来源, 可能包括 (但不限于):国内外临床试验结果、动物模型体内疗效数据、体外数据, 可供 FDA 考虑。 FDA还将评估产品的质量和数量 现有证据,考虑到科学知识的当前状态。
[添加粗体]
法律说明:对于“已知和潜在利益”超过“已知和潜在风险”的含义,没有法律标准,也没有法律定义。对于风险收益分析“可能”基于的可接受的“可用证据”,也没有定性或定量的法律定义。实际证据可能为零,但相信产品具有很多潜在好处而不是很多潜在风险,并且这将满足这一“法定要求”。
- 别无选择
FDA 要想发布 EUA,必须没有足够的、经批准的和可用的替代品来替代候选产品来诊断、预防或治疗疾病或病症。如果批准的替代品的供应不足以完全满足紧急需求,则潜在的替代产品可能被视为“不可用”。
法律质疑:除了伊维菌素和羟氯喹等 Covid-19 替代疗法受到严重且可能构成犯罪的诽谤/取缔之外,何时出现了“预防 Covid-19”(购买 mRNA 疫苗的唯一目的)的替代疗法? ) – 例如 Paxlovid – 这将使 mRNA 疫苗的 EUA 不再合法?
以下是所有这些“法定标准”在实际中是如何得到满足的 BioNTEch/辉瑞 Covid mRNA 疫苗的紧急使用授权:
我得出的结论是,按照授权范围(第 II 节)中所述进行管理时,紧急使用辉瑞 BioNTech COVID-19 疫苗来预防 COVID-19 符合《授权范围》第 564(c) 条下颁发授权的标准该法案,因为:
- SARS-CoV-2 可能会导致感染该病毒的人类出现严重或危及生命的疾病或病症,包括严重呼吸道疾病;
- 根据 FDA 掌握的全部科学证据,有理由相信辉瑞 BioNTech COVID-19 疫苗 可能有效预防 COVID-19,并且在本授权中描述的条件下使用时,辉瑞 BioNTech COVID-19 疫苗的已知和潜在益处 用于预防 COVID-19 时 超过其已知和潜在的风险;和
- 目前没有足够的、经批准的和可用的替代方案来紧急使用辉瑞 BioNTech COVID-19 疫苗 预防新冠肺炎 (COVID-19).
[添加粗体]
注意:FDA 权衡疫苗的潜在益处和风险并确定其“可能有效”的唯一情况是 预防 Covid-19.
没有考虑、没有实际或潜在益处的证据,也没有确定疫苗有任何其他潜在功效,包括:降低严重疾病的风险、降低住院风险、降低死亡风险,降低与 Covid-19 实际或潜在相关的任何疾病的风险。
因此,人们可能会合理地质疑疫苗“安全有效”的任何说法的合法性,而不是“用于预防 COVID-19”——众所周知,疫苗在上市后很快就不会这样做。介绍了。
如果人们被告知 BioNTech/辉瑞 mRNA 疫苗在预防 Covid-19 以外的其他方面“安全有效”,并且如果他们因不接种疫苗除了预防 Covid-19 之外的任何其他方面而受到任何后果的威胁,他们可能会这样做吗?有合法的论据证明他们是在欺诈性索赔下被非法胁迫服用未经批准的产品吗?
未经批准产品的 EUA 第三级要求
一旦我们获得了针对 EUA 的紧急声明,一旦 FDA 宣布该产品可能有效,并且任何可用的证据(从零到无穷大)都表明其益处大于风险(由 FDA 认为这些可能的因素确定) be),还有一层非安全、非功效相关的监管。
这是如何 2018 年国会研究服务部关于 EUA 的报告 解释一下:
FFDCA §564 指示 FDA 在 EUA 中施加某些必需的条件,并在适当的情况下允许附加酌情条件。所需条件有所不同,具体取决于 EUA 是针对未经批准的产品还是针对已批准产品的未经批准的使用。对于未经批准的产品,使用条件必须:
(1) 确保管理该产品的医疗保健专业人员收到所需的信息;
(2) 确保接受该产品的个人收到所需的信息;
(3) 规定与产品相关的不良事件的监测和报告;和
(4) 规定制造商的记录保存和报告。
法律问题:“所需信息”到底是什么?我们知道人们被告知这些疫苗已获得紧急使用授权。但他们是否被告知,这意味着“证据水平较低”,低于其他医疗产品“安全有效”声明所需的证据水平?他们是否被告知,根据产品是否具有 EUA 或其他类型的授权,“安全有效”的级别也不同?
注意:法律要求有一种方法来监测和报告不良事件。但是,它没有说明由谁监控、报告的标准是什么以及根据报告采取行动的门槛是多少。
EUA 与其他药物/疫苗审批途径的比较
作为研究员/作家 萨莎·拉蒂波娃 指出,很多人对 EUA 感到困惑,因为它听起来很像 EAU,代表“扩展访问使用”。这是当特定患者群体(例如,预期寿命以月为单位的 IV 期癌症患者)有迫切需要时,向医疗产品授予的一种授权,这些患者愿意冒不良事件甚至死亡的风险来换取使用权进行实验性治疗。
紧急使用授权与扩展访问使用没有任何关系,也没有任何相似之处。
法律研究人员强调的表格整齐地列出了授权医疗产品的各种法律途径 凯瑟琳·瓦特。该表是 2020 年 FDA-CDC 联合学习会议演示文稿的一部分: 关于使用医疗对策的监管更新.
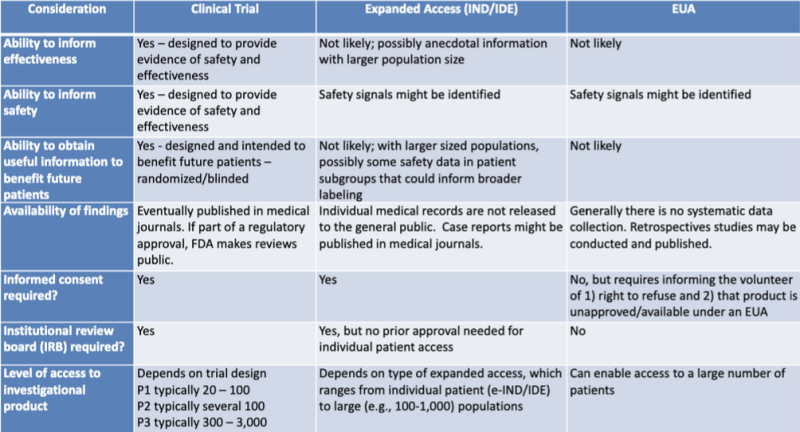
该表非常清楚地表明,EUA 流程不太可能提供有关产品有效性的信息,并非旨在提供安全性证据,不太可能提供有益于未来患者的有用信息,不涉及系统数据收集,不需要回顾性研究,没有知情同意,也没有机构审查委员会。
此外,在一个 2009年国家医学研究所学术刊物,瓦特也强调了这一点,题为“医疗对策:分配紧急使用授权和邮政模式 - 研讨会摘要”,我们在第 28 页上找到了这一声明。 XNUMX:
重要的是要认识到 EUA 不是开发路径的一部分;它是一个完全独立的实体,仅在紧急情况下使用,并且不属于药品审批流程的一部分。
这是否意味着基于 EUA 批准的 Covid-19 对策是非法的?这是否意味着没有合法的方式来声称 EUA 产品“安全有效”,因为它不是药品审批流程的一部分?
结论
鉴于本文和前面的所有信息,这一点非常明显 部分1BioNTach/辉瑞 Covid mRNA 疫苗是根据军事法开发、制造和授权的,该法律保留用于涉及生物战/恐怖主义的紧急情况,而不是影响整个平民的自然发生的疾病。
因此,当产品被认为对全体平民“安全有效”时,我们期望遵守的法规和监督并不是法律要求的。
这一分析是否可以用来质疑那些了解 EUA 含义的政府官员所声称的“安全有效”的合法性?还有其他法律后果吗?
我希望如此。
重要的是,迄今为止,在针对 Covid mRNA 疫苗提出的法律挑战中,(据我所知)还没有关于军事法(如 OTA 和 EUA)是否可以适用于民用情况的裁决。然而,地方法院法官迈克尔·特伦卡尔 (Michael Truncale) 在他的法庭声明中发表了一份声明。 举报人案件被驳回 布鲁克·杰克逊诉文塔维亚和辉瑞,记住这一点很重要。
在此,法官承认 BioNTech/辉瑞 mRNA 疫苗协议是一项军事 OTA,但他拒绝就其在非军事情况下的适用性(自然发生的疾病,100 亿剂大部分不用于军事用途)做出裁决。发出:
军事人员和平民都接种了疫苗这一事实并不表明获得疫苗与提高军队的任务效率无关。更重要的是,杰克逊女士实际上要求法院否决国防部行使其他交易授权购买辉瑞疫苗的决定。但正如美国最高法院长期以来所强调的那样,“关于军队的组成、训练、装备和控制的复杂、微妙和专业的决定本质上是专业的军事判断”。 吉利根诉摩根,413 美国 1, 10 (1973)。因此,“很难想象在政府活动的哪个领域法院的权限较小。” ID。本法院不会否决国防部关于国家紧急状态期间任务有效性的判决。
这只是最终取缔在 Covid-19 紧急情况期间批准的所有 mRNA 产品以及根据 Covid-19 批准程序批准的任何后续 mRNA 产品的斗争中仍然存在的众多法律障碍之一。
发表于 知识共享署名4.0国际许可
如需转载,请将规范链接设置回原始链接 褐石研究所 文章和作者。









